1. Definitie vaatprothese infectie
In de literatuur bestaat geen duidelijk consensus over de diagnostische criteria van een VPI. De diagnose VPI wordt als zeer waarschijnlijk geacht indien minimaal twee van de drie (a en/of b) criteria aanwezig zijn (en deze criteria niet op een andere manier verklaard kunnen worden):
- Microbiologische criteria:
- 1 positieve peri-prothetische kweek en/of 1 positieve bloedkweek. Indien het een commensaal, laagvirulent micro-organisme betreft (bv. coagulase negatieve stafylokokken (o.a. S. epidermidis, S. haemolyticus), Cutibacterium acnes of Corynebacteriën) dan dienen minimaal 2 kweken positief te zijn met hetzelfde micro-organisme en hetzelfde resistentiepatroon.
- Coxiella burnetti anti-fase I IgG-antistoftiter ≥ 1:800.
- Radiologische of biochemische criteria:
- CRP > 10 mg/L of leucocytose > 10 x 10E9/L.
- Radiologische tekenen van een infectie van de vaatprothese (zie beeldvormend onderzoek voor criteria).
- Klinische criteria:
- Lokale en/of systemische tekenen van een infectie zoals beschreven in tabel 1 (presentatie o.a. afhankelijk van lokalisatie prothese).
2. Diagnostiek
Bij iedere patiënt met een verdenking op een geïnfecteerde vaatprothese, dient onderstaande diagnostiek te worden verricht:
a. Anamnese en lichamelijk onderzoek
Patiënten met één van de volgende risicofactoren hebben een verhoogde kans op het ontwikkelen van een vaatprothese-infectie: 1) plaatsing van de prothese gedurende een spoedoperatie; 2) inadequate peri-operatieve antibiotische profylaxe; 3) incisie via de lies; 4) een bacteriëmie tijdens de opname na het plaatsen van de prothese; 5) multipele interventies voor/na het plaatsen van de vaatprothese; 6) een slechte wondgenezing; 7) een infectie in het gebied rondom de vaatprothese; 8) co-morbiditeit (diabetes mellitus, chronische nierinsufficiëntie, obesitas, gestoorde afweer).
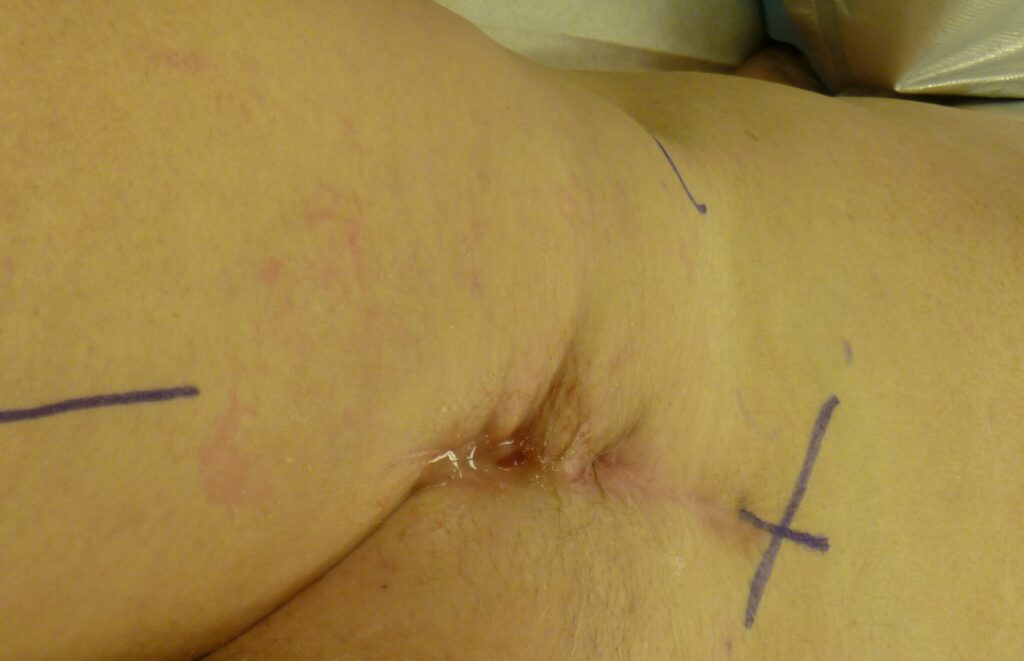
Kenmerkende symptomen voor een geïnfecteerde vaatprothese zijn samengevat in tabel 1. Alhoewel een vroege, post-operatieve prothese infectie zich vaker (per)acuut presenteert, en een late prothese infectie een meer chronisch/sluimerend karakter kent, kunnen veel (lokale) symptomen overeen komen. De symptomen zijn mede afhankelijk van de lokalisatie van de prothese.
Tabel 1. Symptomen van een vaatprothese-infectie
- Koorts (50-75%)
- Koude rillingen
- Pijn ter plaatse van of distaal van de vaatprothese
- Lekkende operatiewond
- Inflammatie v.d. huid ter plaatse van de vaatprothese
- Dehiscentie van het operatielitteken
- Lymfocele / abces rondom het operatielitteken
- Palpabele massa t.h.v. de vaatprothese
- Fistel naar de huid
- (Acute) ischemie ledemaat
- Hoge of lage tractus digestivus bloeding (bij aortaduodenale fistel)
- Ileus (bij geïnfecteerde aortaprothese)
NB: Bij systemische tekenen van een infectie (koorts, koude rillingen) dient tevens gezocht te worden naar een mogelijke alternatieve verklaring (focus onderzoek).
b. Laboratoriumonderzoek
Het onderstaande laboratoriumonderzoek dient te worden verricht:
– Bloedbeeld met leukocyten-differentiatie (machinaal)
– Natrium, kalium, ureum, kreatinine
– LDH, AF, γGT, ASAT, ALAT, bilirubine (zowel direct als indirect)
– CRP
c. Microbiologisch onderzoek.
Het opsporen van het veroorzakende micro-organisme is essentieel voor een succesvolle behandeling. Om deze reden dienen bij voorkeur alle kweken te worden afgenomen zonder antibiotica. Indien de patiënt reeds wordt behandeld met antibiotica, dient (indien de kliniek dit toelaat) het antibioticum te worden gestaakt en dienen er nieuwe kweken te worden afgenomen bij koorts (T > 38.5 graden) of twee weken na staken van de antibiotica. Een uitzondering op deze regels is als de patiënt in aanmerking komt voor een operatie waarbij de gehele vaatprothese vervangen kan worden door een nieuwe. In deze situatie wordt 2 dagen preoperatief gestart met breedspectrum antibiotica. De achterliggende gedachten hierbij is dat het belangrijk is bacteriële loadreductie te bewerkstelligen alvorens een nieuwe “schone” prothese wordt geïmplanteerd. De literatuur laat zien dat deze benadering, waarbij multipele perioperatieve weefsels inclusief de gehele prothese wordt ingestuurd voor kweek, weinig tot geen invloed heeft op de kweek resultaten.
I) Bloedkweken
Bij iedere patiënt met verdenking op een vaatprothese-infectie dienen 3 sets (6 flesjes) bloedkweken te worden afgenomen (ook bij afwezigheid van koorts). Deze moeten ingezet worden met verlengde incubatie. Daarbij dient opgemerkt te worden dat de opbrengst van bloedkweken klein is (~30% van de patiënten heeft een positieve bloedkweek), vermoedelijk omdat vooral het extra-luminale oppervlak van de vaatprothese betrokken is. Bij positieve bloedkweken dienen, na het starten van antibiotische behandeling, herhalingsbloedkweken te worden gedaan vanaf 48 uur na het starten van antibiotica (3x per week 2 sets (4 flesjes)), tot vervolgbloedkweken negatief zijn.
II) Kweken aspiraat
Naast de afname van bloedkweken dient (indien mogelijk) intra-operatief of via een radiologische punctie, een aspiraat rondom de geïnfecteerde vaatprothese te worden afgenomen voor een banale kweek. Een fistel of oppervlakkige wondkweek is over het algemeen niet zinvol om in te sturen. De kans op een fout-positieve uitslag door kolonisatie van de huid is bij fistels groot en kweekuitslagen kunnen om deze reden niet goed worden geïnterpreteerd. Bij kweek-negatieve aspiraties kan op indicatie moleculair onderzoek, of diagnostiek naar mycobacteriën worden ingezet (PCR, kleuring en kweek) (bv bij late infecties bij immuun gecompromitteerde patiënten met expositie aan tuberculose in het verleden).
Bij afname van deze kweken heeft het de voorkeur om contact op te nemen met de arts-microbioloog tijdens kantooruren, om juiste verwerking van het materiaal te garanderen
III) Peroperatieve kweken
In principe bestaat de curatieve behandeling van een geïnfecteerde vaatprothese uit de explantatie van de volledige prothese. Deze prothese dient steriel aangeboden te worden voor microbiologische diagnostiek. In het UMCG worden vaatprotheses gesoniceerd om de bacteriën die zich binnen een biofilm bevinden zo goed mogelijk te kunnen kweken.
Naast de prothese zelf dient, waar mogelijk, meerdere weefsel biopten (~4x) nabij de prothese ingestuurd te worden voor kweek. Wanneer er pus aangetroffen wordt, dient dit in een spuit geaspireerd te worden en met zo min mogelijk lucht (voor de betrouwbaarheid van de anaerobe kweken) afgedopt te worden.
Wanneer een gedeelte van de prothese niet verwijderd kan worden, en de verdenking op infectie van het achterblijvende gedeelte in principe laag is, kan overwogen worden een “snijvlak” kweek in te sturen door een ringetje prothese van het gedeelte dat in situ blijft separaat in te sturen voor kweek, afgenomen met schoon instrumentarium en voorzien van duidelijke vraagstelling en informatie over de herkomst van het materiaal.
Het is van belang dat peroperatief de prothese en overige kweken zo steriel mogelijk afgenomen worden, met zo schoon mogelijk instrumentarium, en direct overgebracht worden in een steriele opvangcontainer. Dit omdat bij het vinden / kweken van micro-organismen het onderscheid tussen infectie en contaminatie soms moeilijk te maken is.
Bij afname van deze kweken heeft het de voorkeur om contact op te nemen met de arts-microbioloog tijdens kantooruren, om juiste verwerking van het materiaal te garanderen.
IV) Moleculair onderzoek
Zoals boven beschreven, dienen in principe alle preoperatieve kweken afgenomen te worden zonder antibiotica. Indien reeds wordt behandeld met antibiotica kunnen de kweken, in overleg met de arts-microbioloog nog uitgebreid worden met moleculair onderzoek. Hiermee kan (bacterieel) DNA worden gedetecteerd, ook van dode micro-organismen.
Een belangrijk nadeel is dat deze methode aanzienlijk minder sensitief is en, in tegenstelling tot de kweek, resistentie van de betreffende bacterie niet kan worden bepaald. Het heeft dus absoluut de voorkeur om het betreffende antibioticum te staken en twee weken nadien alsnog kweken in te sturen, zoals boven beschreven.
Bij het negatief blijven van de kweken en een hoge klinische verdenking, kan contact opgenomen worden met de arts-microbioloog voor overleg of aanvullend moleculair onderzoek zinvol is.
V) Serologie Coxiella burnetii
Indien kweken negatief blijven en/of er twijfel bestaat over de kweekuitslagen in relatie tot het klinisch beeld, dient Q-koorts te worden overwogen. Hiervoor kan serologisch onderzoek worden ingezet op Coxiella burnetii. Een anti-fase I IgG-antistoftiter ≥ 1:800 is bewijzend voor een chronische infectie.
d. Beeldvormend onderzoek.
Bij een klinische verdenking op een geïnfecteerde vaatprothese dient onderstaand beeldvormend onderzoek te worden verricht.
I) Echo doppler
Bij een vaatprothese ter plaatse van de extremiteiten wordt een echo doppler verricht. Indien valse aneurysmata, trombose, en/of peri-prothetische collecties worden gezien kan direct echogeleid worden gepuncteerd voor microbiologisch onderzoek. Bij een positieve echo wordt aansluitend een CT-angiografie of 18F-FDG PET met low dose CT (18F-FDG PET/CT) verricht om de uitgebreidheid van de infectie in kaart te brengen. Vanwege de kans op een fout negatieve uitslag wordt bij een negatieve echo doppler tevens aanvullende beeldvorming gedaan (zie onder).
II) CT-angiografie (CTA)
Bij verdenking op een vroege vaatprothese infectie (≤ 3 maanden postoperatief) is het advies een CTA met contrast te verrichten. De sensitiviteit en specificiteit van een CTA bij een vroege infectie is hoog: respectievelijk 95% en 85%. Echter in een recente systematische review was de sensitiviteit en specificiteit van een CTA bij verdenking op VPI respectievelijk 67% en 63%. Radiologische tekenen voor een vaatprothese infectie zijn: peri-prothetische infiltratie, (vocht)collecties, luchtbellen, valse aneurysmata, en lokale intestinale wandverdikking bij aortale vaatprothesen. Het is echter niet goed bekend hoe lang sommige van deze tekenen postoperatief kunnen voorkomen. Het is beschreven dat vocht rondom de vaatprothese nog tot ruim 2 maanden na de operatie aanwezig kan zijn. Luchtbellen zijn over het algemeen < 1 week postoperatief verdwenen, maar kunnen echter tot 7 weken postoperatief blijven bestaan.
III) 18F-FDG-PET/CT
Bij een verdenking op een late / chronische infectie (≥ 3 maanden postoperatief) wordt een gecombineerde 18F-FDG PET/CT geadviseerd. De sensitiviteit van een CTA is in dit stadium van infectie laag (±67%) en wordt om deze reden als mono diagnostisch middel afgeraden. De sensitiviteit en specificiteit van een 18F-FDG PET/CT bij verdenking op een late/chronische infectie is hoog; respectievelijk 95% en 80%. Een focale of heterogene opname van FDG langs de vaatprothese is zeer suggestief voor een infectie. Een homogene opname langs de vaatprothese past bij fysiologische opname en kan tot vele jaren na het plaatsen van de prothese aanwezig blijven. Een bijkomend voordeel van een 18F-FDG PET/CT is dat tevens naar eventuele strooihaarden van een gedissemineerde infectie en/of een alternatief focus van infectie gekeken kan worden.
3. Behandeling
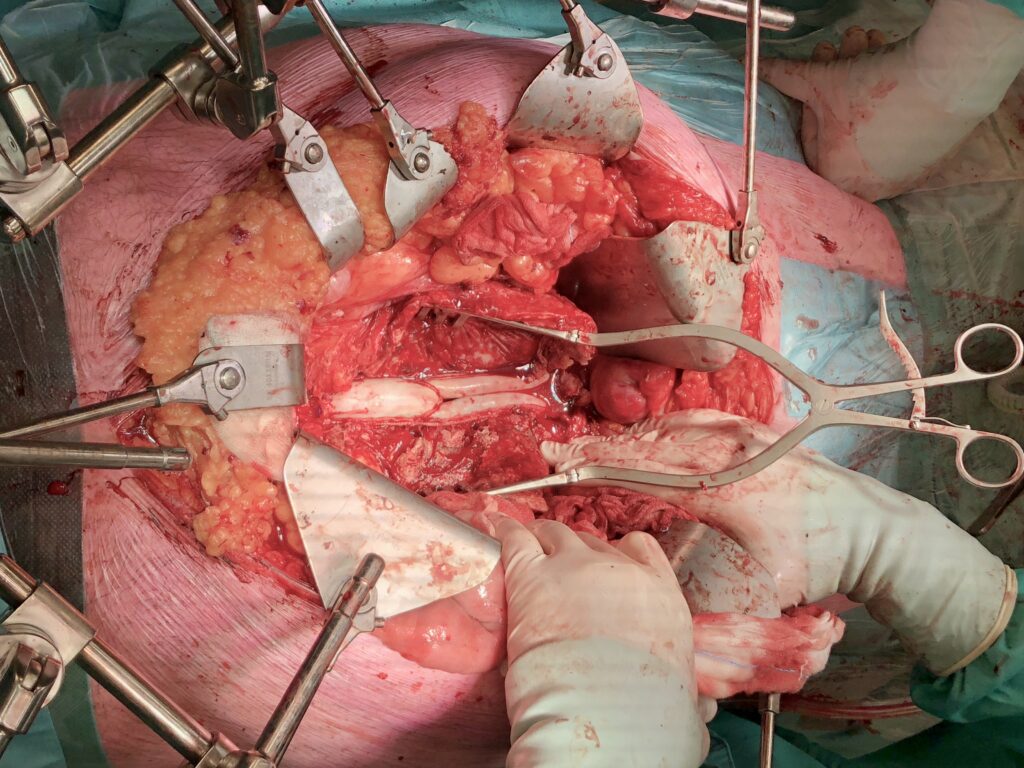
De behandeling van een geïnfecteerde vaatprothese bestaat uit een combinatie van chirurgische interventie en antibiotische behandeling. Indien de infectie secundair is aan een bacteriëmie vanuit een ander focus, of er sprake is van vroege prothese infectie, kan worden getracht de prothese door chirurgisch débridement, indien nodig, en antibiotica therapie te behouden. De haalbaarheid hiervan wordt in het wekelijks MDO besproken. Een langer bestaande infectie van een vaatprothese is echter, ten gevolge van de biofilm-formatie, en “schoon” krijgen met antibiotica is niet haalbaar. Het volledig verwijderen van de vaatprothese in combinatie met antibiotische behandeling is dan de enige manier voor het bereiken van curatie.
Is het verwijderen van de vaatprothese vanwege co-morbiditeit en/of revascularisatie mogelijkheden niet haalbaar dan is chirurgisch débridement (indien nodig/mogelijk) met aansluitend levenslange antibiotische suppressie-therapie een alternatieve behandelkeuze.
Chirurgische behandeling
De meest adequaat behandeling van VPI bestaat uit het verwijderen van de geïnfecteerde prothese, re-vascularisatie (via een anatomische route of via een niet-geïnfecteerde extra-anatomische route), en aanvullende antimicrobiële therapie. Een behandeling zonder het verwijderen van de geïnfecteerde vaatprothese, toegepast bij patiënten die geen uitgebreide operatieve reconstructie kunnen ondergaan, of bij patiënten met een prothese in een lastig te bereiken gebied van het lichaam, geeft een hoge mortaliteit. Antibiotica zal dan levenslang genomen moeten worden, bij voorkeur op geleide van kweken (middels bloedkweken en/of echo- of CT geleide punctie: zie diagnostiek). Indien de patiënt klinisch achteruit gaat ondanks optimale antibiotische behandeling zal een explantatie alsnog overwogen moeten worden. Voor iedere patiënt zal een op maat gemaakt behandelplan nodig zijn.
Antibiotische behandel plan UMCG
Het veroorzakende micro-organisme is sterk afhankelijk van de locatie van de prothese; zo zijn bacteriën uit de darm betrokken bij prothese-infecties van abdominale of lies-grafts, en relatief vaker huidbacteriën bij perifere grafts. Bij een geïnfecteerde vaatprothese is het van groot belang dat er voldoende diagnostiek ingezet wordt en er een behandelplan is, alvorens er antibiotica gestart worden. Dit heeft verschillende redenen: 1) het starten van antibiotica compromitteert de diagnostiek 2) het al dan niet chirurgisch ingrijpen, en de uitgebreidheid van chirurgisch ingrijpen, beïnvloedt de keuze van de te starten antibiotica 3) bij een open verbinding tussen de prothese en een gekoloniseerde tractus (bv tractus digestivus) dreigt uitselectie van resistentere bacteriën, wat de vervolgtherapie aanzienlijk kan compliceren. Bij een weinig zieke patiënt (zonder tekenen van sepsis) dient daarom diagnostiek en vaststellen van behandelplan eerst plaats te vinden, en kan met starten van antibiotica gewacht worden. Bij een septische patiënt of een ernstig ziekte patiënt dienen antibiotica vanzelfsprekend zo spoedig mogelijk gestart te worden. De behandeling is hierbij in principe initieel gericht op behandeling van de sepsis en niet op curatie van de prothese-infectie. Voor empirisch beleid, zie umcg.swabid.nl. Indien patiënt gekoloniseerd is met bijzonder resistente Gram-negatieve staven (i.e. ESBL-positief) of met MRSA, dient de empirische therapie aangepast te worden i.o.m. MMB/infectieziekten.
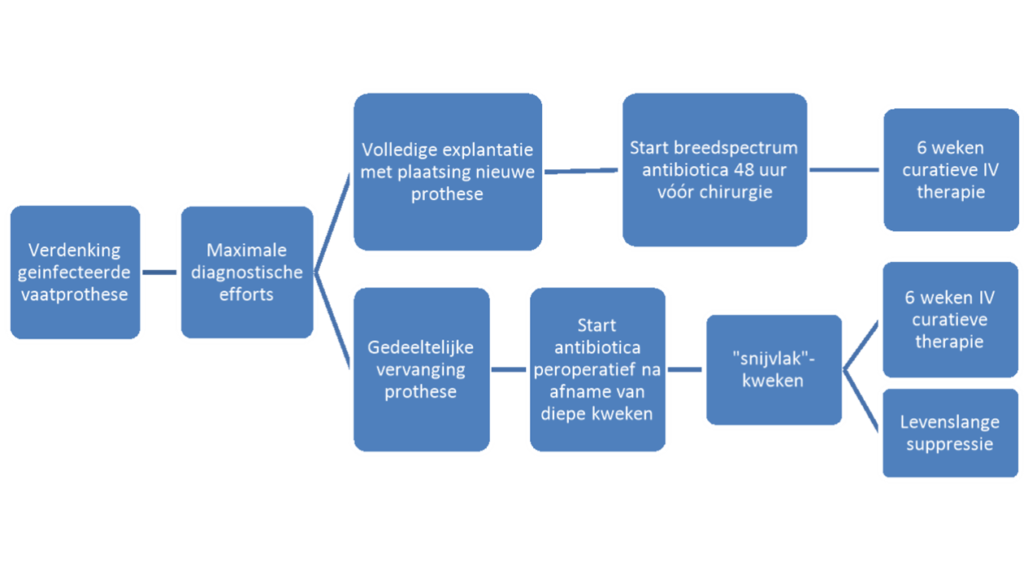
Bij een weinig zieke patiënt (zonder tekenen van sepsis), wordt de therapie pas 2 dagen voor de operatie gestart bij in opzet volledige vervanging van de prothese, en peroperatief bij een partiële vervanging van de geïnfecteerde prothese (zie flow-chart). De achterliggende gedachte is dat bij een volledige vervanging van de prothese het plaatsen in zo schoon mogelijk gebied gebeurt. Hierbij weegt minimalisatie van re-infectie van de nieuwe prothese zwaarder dan de afname van gevoeligheid en betrouwbaarheid van peroperatieve kweken (al blijkt uit eigen data en uit literatuur dat het starten van antibiotica 48 uur preoperatief, geen significant negatieve invloed heeft op de kweken).
De empirische antibiotische therapie bij volledige vervanging is er op gericht de meest voorkomende verwekkers te dekken. Bij onderstaande empirische behandeling (tabel 2) is geen rekening gehouden met eventuele resistente micro-organismen waar de patiënt mee gekoloniseerd kan zijn. Er moet dus altijd, voordat antibiotica worden gestart, gecontroleerd worden of met eerdere micro-organismen en/of resistentiepatronen rekening moet worden gehouden. De keuze, dosering en duur van de antibiotische therapie dient in principe altijd te worden overlegd met de arts-microbioloog en infectioloog. Afhankelijk van de voorgeschiedenis en de klinische presentatie (bv bij immuungecompromiteerden of bij een hoge verdenking op darm betrokkenheid) kan er mogelijk voor een ander empirisch beleid worden gekozen. Voorafgaand aan het starten met antibiotica dienen altijd afdoende kweken te worden afgenomen. Bij bekend worden van kweken kunnen de antibiotica eventueel worden versmald of anderszins aangepast.
Tabel 2. Empirische antibiotische behandeling
Bij abdominale vaatprothesen en/of prothese in de liesregio:
- Piperacilline/tazobactam: opladen met eenmalig 4 gram piperacilline (overeenkomend met 4 gram piperacilline + 500 mg tazobactam), gevolgd door 16 gram (overeenkomend met 16 gram piperacilline + 2 gram tazobactam)/24uur continue1 i.v. plus
- Vancomycine 20 mg/kg oplaaddosering (maximale inloopsnelheid 1 gram in 1 uur), vervolgens 30 mg/kg/24 uur continue1,2 plus
- Caspofungin 1dd 150 mg i.v.
In het geval van milde allergie voor penicilline (e.g. rash)3:
- Ceftazidim : opladen met eenmalig 2 gram, gevolgd door 6 gram/24uur continue1 i.v. plus
- Metronidazol 3dd 500 mg oraal plus
- Vancomycine 20 mg/kg oplaaddosering (maximale inloopsnelheid 1 gram in 1 uur), vervolgens 30 mg/kg/24 uur continue1,2 plus
- Caspofungin 1dd 150 mg i.v.
NB: In geval van overige relevante allergieën (e.g. anafylaxie); overleg met arts-microbioloog of infectioloog voor alternatief.
Bij perifere grafts zonder lies betrokkenheid:
- Cefuroxim : eenmalig opladen met 1500 mg, gevolgd door 6000 mg/24uur continue1 i.v. plus
- Vancomycine 20 mg/kg oplaaddosering (max 1 gram in 1uur), vervolgens 30 mg/kg/24 uur continue1,2
In het geval van milde allergie voor penicilline (e.g. rash)3 kan bovenstaand beleid gewoon worden gehanteerd.
NB: In geval van overige relevante allergieën (e.g. anafylaxie); overleg met arts-microbioloog of infectioloog voor alternatief.
Let op: start bovenstaande regime 48 uur vóór chirurgie indien volledige vervanging van de geïnfecteerde prothese mogelijk is. Indien alleen partiële vervanging van de geïnfecteerde prothese mogelijk is start na afname van diepe intra-operatieve kweken. De antibiotische therapie wordt aangepast a.d.h.v. de intra-operatieve kweken.
1 Dosisaanpassing is nodig bij afwijkende nierfunctie.
2 Spiegelcontrole: eerste vancomycine spiegel wordt standaard meegeorderd bij voorschrijven (streefwaarde: 20-25 mg/L); dosering aanpassen o.g.v. spiegelmeting i.o.m. ziekenhuisapotheker.
3 Consult allergoloog geïndiceerd, vaak kan op grond van anamnese het eerste keus middel vaak gewoon gegeven worden en/of kunnen huid testen op de afdeling volgen.
Bovenstaande therapie wordt aangepast op geleide van de kweken. Indien de geïnfecteerde prothese in zijn geheel is verwijderd, volstaat in principe 6 weken intraveneuze therapie voor het bereiken van curatie. Afhankelijk van het postoperatieve beloop wordt per patiënt tijdens de vaatinfectiebespreking besloten of de 6 weken therapie volstaat of dat de antibiotische therapie verlengd wordt of dat er alsnog op levenslange suppressietherapie overgegaan wordt. Vooralsnog is er geen literatuur die aantoont of er onderscheid in behandeling gemaakt kan worden tussen infectie van kunstmateriaal en biologisch materiaal. Op basis van lokale ervaring, kan er bij infectie van een boviene patch of bij vervanging van een geïnfecteerd vaatprothese door een autologe vene, er voor gekozen worden korter dan 6 weken te behandelen. De minimale behandelduur bedraagt dan in principe 2 weken (uitgaande van een weke delen infectie).
Indien het kunstmateriaal niet kan worden verwijderd, zal de patiënt met levenslange suppressie therapie moeten worden behandeld. Over het algemeen zal eerst 2-4 weken inductie behandeling gegeven worden met intraveneuze antibiotica om de infectie zo veel mogelijk in remissie te brengen. Op basis van klinisch beloop, CRP en uiteindelijke prognose, kan deze duur verkort of verlengd worden. De inductiebehandeling wordt gevolgd door levenslange antibiotische suppressie therapie. Bij een zeer vroege infectie en/of bij het ontstaan van een bacteriëmie in de vroeg postoperatieve fase, kan in sommige gevallen worden getracht de prothese te behouden en de infectie conservatief met antibiotica te behandelen. Er is echter geen literatuur die laat zien dat er onderscheid gemaakt kan worden tussen een vroege en een late vaatprothese infectie met betrekking tot conservatieve behandeling en men dient er vanuit te gaan dat de kans op therapiefalen hoog is, zeker indien er geen chirurgisch débridement heeft plaatsgevonden.